Neurociencia y psiquiatría. Parte I
- Consejo Mexicano Neurociencias

- 19 nov 2019
- 21 Min. de lectura

Los avances en las investigaciones del cerebro se han sucedido con un ritmo rápido y creciente durante los últimos veinte años y han alcanzado un punto en que la neurociencia puede considerarse justificadamente como el fundamento biomédico de la psiquiatría. El crecimiento logarítmico de nuestra comprensión de la organización y el funcionamiento del cerebro ha hecho posible empezar a analizar la conducta a nivel molecular. Estos avances han permitido la explotación fructífera de metodologías experimentales y diagnósticas centradas en el cerebro como la resonancia nuclear magnética, la tomografía por emisión de positrones y el análisis topográfico de la actividad eléctrica cerebral, para caracterizar irregularidades estructurales, metabólicas y electrofisiológicas en cerebros de pacientes psiquiátricos. Además, los avances paralelos en genética humana y en biología molecular nos permitirán definir las bases genéticas de las enfermedades hereditarias del comportamiento, y fundamentalmente, determinar los mecanismos moleculares y celulares responsables de estos trastornos. Estos desarrollos están reduciendo progresivamente la separación cartesiana entre mente y cerebro, mejorando nuestra capacidad para correlacionar la experiencia mental con los procesos cerebrales.
La investigación en el campo de la neurociencia ofrece importantes oportunidades a la psiquiatría por su aplicación a la asistencia de los pacientes y, a largo plazo, porque aumenta la comprensión de la experiencia y del comportamiento humanos. Por ello, es esencial para la psiquiatría aprovechar esta área de conocimiento de rápida evolución. Por consiguiente, la intención de este capítulo es revisar los aspectos moleculares y celulares de la investigación en neurociencia. No es posible, por limitación de espacio, tratar en profundidad la totalidad de los avances en la investigación del cerebro. Por tanto, hemos preferido abordar los temas principales y las estrategias más destacadas de la investigación en neurociencia, que afectan directamente a la psiquiatría. Esperamos que este estudio servirá como fundamento para entender el cuerpo de conocimientos actuales y para evaluar críticamente los progresos futuros en esta rama de la ciencia, así como su utilidad para los psiquiatras.
ANATOMÍA FUNCIONAL DE LA NEURONA
La neurona es una célula altamente especializada, tanto anatómica como bioquímicamente, para llevar a cabo la función de procesamiento de la información. En el sistema nervioso hay cientos de tipos de neuronas, cada una de las cuales se ocupa de funciones especializadas. A diferencia de muchos tipos de células, como las que constituyen el hígado, la epidermis o el sistema hematopoyético, que son capaces de realizar la división celular durante toda la vida del individuo, el alto grado de especialización de la neurona generalmente le impide llevar a cabo la división celular una vez esta célula es completamente madura. Esta incapacidad de la mayoría de las neuronas de experimentar una mitosis, influye de forma evidente en la irreversibilidad de las lesiones del sistema nervioso. La neurona puede dividirse en cuatro componentes distintos: el cuerpo celular o soma, las dendritas, el axón y las sinapsis (ver Figura 1-1).

En el soma de la neurona tiene lugar la síntesis de prácticamente todas las proteínas y otros componentes estructurales. Situado en el soma se encuentra el núcleo, que contiene el material genético en forma de ácido desoxirribonucleico (ADN). La información para la síntesis de proteínas está codificada por los genes que contiene el ADN: esta información genética se lee mediante un proceso llamado transcripción en el cual el ADN sirve de plantilla para la síntesis del ácido ribonucleico (ARN). Las primeras transcripciones de ARN que resultan se procesan y dan lugar al ARN mensajero (ARNm), que se exporta del núcleo al citoplasma del soma. Allí, el ARNm se traduce en proteínas gránulos llamadas ribosomas. La rica concentración alrededor del núcleo de este sistema de síntesis de proteína a través del ARNm explica la presencia de la « s u stancia de Nissl», que se observa en el soma de las neuronas del tejido cerebral al emplear tinciones vitales. La síntesis de proteínas ocurre mayoritariamente en el soma, pero los ribosomas activos se han detectado recientemente en dendritas, lo cual aumenta la posibilidad de que exista un control local de síntesis de proteínas por estímulo neuronal. El tamaño del soma neuronal es aproximadamente proporcional a la extensión de las proyecciones de las dendritas y de los axones. Hay que destacar que el soma tan sólo contiene un porcentaje muy reducido de volumen neuronal; la parte principal del volumen celular se distribuye entre el axón y el árbol dendrítico. Por esta razón, los requerimientos metabólicos y sintéticos del soma neuronal son inmensos, ya que el soma neuronal nutre al resto de la neurona. Los materiales sintetizados en el interior del soma son transportados a lo largo de los axones y las dendritas por transporte axoplasmático para reemplazar los componentes inactivados. Por el contrario, los productos de desecho de las proteínas metabólicas y estructurales de los axones y las dendritas, se transportan en sentido inverso hacia el cuerpo celular para ser catabolizados.
El axón es una fina extensión tubular del cuerpo celular por el que circulan impulsos eléctricos hacia la terminación nerviosa. La neurona emite solamente un axón, cuya longitud varía desde menos de un milímetro en las interneuronas, hasta más de un metro en las neuronas motoras que inervan las extremidades. El axón, cuando se acerca a su campo de inervación, puede ramificarse en diversos grados, dependiendo del número de neuronas con las que establezca sinapsis. Algunas neuronas pueden tener uniones sinápticas muy específicas y restrictivas, mientras que los axones de otras neuronas, como los de las neuronas dopaminérgicas nigrostriadas, pueden ramificarse para conectar con millones de neuronas en su zona terminal de inervación. Las dendritas son extensiones tubulares múltiples del cuerpo celular neuronal que sirven de estructura primaria para la recepción de uniones sinápticas procedentes de otras neuronas. (Algunas neuronas, como las células Purkinje en el cerebelo y algunos componentes del sistema reticular del tronco del cerebro, que poseen funciones integradoras, poseen «á r b o l e s» dendríticos muy extensos que reciben input sináptico de miles de neuronas. La sinapsis es una estructura especializada en la que la terminación nerviosa de una neurona se pone en contacto con la parte receptora de la neurona adyacente; generalmente, la transmisión se consigue por mensajeros químicos llamados neurotransmisores, pero en algunos casos puede tratarse de mensajeros eléctricos.
La sinapsis consiste en una evaginación de las regiones terminales del axón denominada botón terminal, que está finamente sujeta a la membrana dendrítica de la neurona adyacente por contactos especializados. La membrana dendrítica de la sinapsis es muy rica en receptores que responden al neurotransmisor liberado por el botón terminal. El propio botón terminal contiene numerosas estructuras celulares que le permiten mantenerse relativamente independiente a nivel metabólico y funcional del cuerpo celular neuronal. Así pues, contiene mitocondrias (unidades energéticas de la celula que generan ATP (adenosín 5’ -trifosfato) a partir del metabolismo de la glucosa), enzimas implicados en la síntesis y en la degradación del neurotransmisor y vesículas de almacenamiento que mantienen importantes concentraciones de neurotransmisor en estado protegido. Cuando el tejido cerebral se homogeniza cuidadosamente en una solución isotónica de sacarosa, la sinapsis con el botón terminal y la membrana postsináptica adyacente especializada se separan del resto para formar sinaptosomas. Estas estructuras se han utilizado para estudiar aspectos bioquímicos de la neurotransmisión sináptica del cerebro.
La propiedad fundamental de todas las neuronas es la naturaleza excitable de su membrana, que les confiere la capacidad de generar y transmitir una onda de despolarización electroquímica. Esta propiedad deriva de la naturaleza especializada de la membrana neuronal, que mantiene un gradiente de voltaje y posee canales de iones sensibles al voltaje. Dos tipos de proteínas son mayoritariamente responsables de la regulación de iones y por tanto del voltaje de la membrana neuronal. Estos son las bombas iónicas y los canales de sodio voltaje. Basándose en la clonación molecular que tienen codificada algunas de estas bombas iónicas y canales de sodio voltaje, parece ser que cada uno representa una familia de genes que deriva de su gen ancestral común. Aún más importante, la clonación molecular ha iniciado una era de estructura y análisis detallados de la actividad que muy probablemente conducirá a la creación de fármacos neuroactivos más eficaces. Las bombas críticas para establecer el gradiente fisiológico de iones que se encuentran a lo largo de la membrana neuronal son una bomba de ATPdependiente, la ATPasa que extrae dos iones de N a+ por cada ion de K+ que entra; y bombas que extraen Ca+ + de la neurona. Durante los descansos, hay altas concentraciones de Na+ y Cl– fuera de la neurona y una concentración relativamente alta de K+ dentro de la neurona.
La fuente principal de carga negativa dentro de la neurona proviene de aminoácidos de carga negativa. La membrana se polariza en su totalidad con una diferencia de voltaje a lo largo de la membrana de aproximadamente –70mV, en comparación con el exterior de la neurona. Esto se llama el potencial de descanso de la m e m b r a n a. Cuando la membrana neuronal se despolariza hasta llegar a aproximadamente –35mV, se produce un «potencial de acción» que representa a la actividad de «d i s p a r o» de la neurona, y es el mecanismo fundamental de la estimulación neuronal. Concretamente, a medida que el interior de la neurona se vuelve positivo, los canales especializados de sodio voltaje se abren, lo que permite que más iones positivos entren en la neurona (Figura 1-1). El potencial de acción representa la extensión de la despolarización por la apertura vectorial de los canales de sodio. Debido a que cada canal de Na+ que se abre en sucesión proporciona la carga positiva para que el siguiente segmento del axón alcance el umbral para abrir sus canales de Na+ , el potencial de acción es autorregenerador y una vez ha empezado, se propaga a lo largo del axón sin problemas. Al llegar al terminal presináptico, el potencial de acción causa la apertura de los canales de Ca+ + voltaje que se encuentran allí (denominados canales de Ca+ + tipo N, en contraposición con los canales Ca+ + tipo L, bloqueados por los bloqueantes de canales de Ca+ + tipo verapamino utilizados en la clínica). El Ca+ + entra e inicia una serie de procesos bioquímicos complejos pero rápidos que causan una fusión de las vesículas contenedoras de neurotransmisores con la membrana presináptica y por tanto liberan su contenido en la sinapsis, permitiendo una transmisión sináptica. Debido a que la entrada de la carga positiva despolariza la membrana, acercando así la neurona al umbral para «d i s p a r a r» un potencial de acción, los receptores de neurotransmisores que permiten la entrada de cationes como Na+ o Ca+ + son excitadores y los que causan la entrada de aniones como Cl– , o la salida de cationes, como K+ , son inhibidores. Las dendritas suman continuamente todos los potenciales de las aferencias excitadoras e inhibidoras, para determinar si la neurona generará o no un potencial de acción. La organización espacial de la inervación de la neurona no es casual sino que está altamente organizada. Las aferencias excitadoras están generalmente concentradas en el extremo distal de las dendritas, mientras que las aferencias inhibidoras están localizadas principalmente en el extremo proximal de las dendritas y alrededor del soma. Esta distribución espacial significa que las aferencias inhibidoras tienen un papel predominante al determinar si una neurona generará o no, un potencial de acción. Debido a que el potencial de acción es autorregenerador, la decisión de «d i s p a r a r» un potecial de acción es un proceso de todo o nada, y cuando el equilibrio se decanta hacia la despolarización adecuada en la región del axón proximal, donde la densidad de los canales de sodio es alta, se genera un potencial de acción (Figura 1-1).
NEUROTRANSMISORES
Aunque no suele apreciarse, cabe recordar que la psiquiatría, especialidad médica que se ocupa de muchos aspectos de la comunicación, fomentó la mayor parte de las primeras investigaciones sobre los mecanismos de la comunicación química entre las neuronas. Debemos señalar que la existencia de neurotransmisores cerebrales fue propuesta por primera vez con la hipótesis de que la esquizofrenia sería el resultado de una anomalía del metabolismo del neurotransmisor adrenalina, por lo que se generaría un metabolito psicomimético, el adrenocromo. Aunque esta hipótesis finalmente no pudo probarse, al principio de los años sesenta promovió numerosos estudios para caracterizar la disposición metabólica de las catecolaminas cerebrales. Más recientemente, esta estrategia de estudio de la comunicación neuronal en el cerebro ha conducido a la identificación de un conjunto rápidamente creciente de sustancias que actúan como neurotransmisores. Así pues, a mediados de los años sesenta se creía que sólo un reducido número de sustancias satisfacían el criterio de neurotransmisores cerebrales «p u t a t i v o s» . El término putativo se refiere al hecho de que es muy difícil satisfacer todos los criterios para que una sustancia se considere sin lugar a dudas un neurotransmisor cerebral (ver Tabla 1-1). Durante la última década, el número ha crecido aproximadamente diez veces (ver una lista parcial en las Tablas 1-2 y 1-3). Además, actualmente disponemos de un dato convincente y es que la mayoría de neuronas liberan más de un neurotransmisor, a menudo una pequeña molécula neurotransmisora y uno o más péptidos. La siguiente exposición se centra en ejemplos representativos de los dos tipos principales de neurotransmisores en el cerebro: a) los neurotransmisores «clásicos» como la adrenalina, que se sintetizan localmente en las terminaciones nerviosas, y b) los neurotransmisores neuropéptidos como la beta-endorfina, que se sintetizan en el soma neuronal. Para un estudio detallado, ver Nestler (1993) y Cooper et al. (1991).
Catecolaminas
El sistema de neurotransmisores mejor estudiado desde el punto de vista de la síntesis, el almacenamiento, la liberación y el metabolismo, es el sistema catecolaminérgico. Los principios establecidos para la neurotransmisión catecolaminérgica periférica y central tienen una aplicabilidad general al resto de los sistemas de neurotransmisores clásicos. Los neurotransmisores catecolaminérgicos comprenden la dopamina, la noradrenalina y la adrenalina. Aunque cada uno de ellos actúa como neurotransmisor diferenciado en los sistemas neuronales específicos del cerebro, todos ellos forman parte de una misma ruta biosintética (Figura 1-2). Las enzimas responsables de la síntesis de catecolaminas se sintetizan en el soma de la neurona y se transportan a lo largo del axón hasta los terminales presinápticos. Las neuronas que usan dopamina como neurotransmisor poseen las primeras dos enzimas de la ruta, tirosina hidroxilasa y dopa decarboxilasa. Las neuronas que liberan noradrenalina presentan una tercera enzima, dopamina-betahidroxilasa, y las neuronas que producen adrenalina presentan una cuarta enzima, feniletanolamina N-metil transferasa (PNMT). Debido a que la tirosina hidroxilasa es una enzima de flujo limitado y altamente controlado, los mecanismos reguladores generales que determinan la disponibilidad del neurotransmisor son comunes para todos los neurotransmisores de este grupo.
Las rutas sintéticas de los neurotransmisores clásicos, generalmente, aunque no de manera invariable, implican la conversión de un precursor inactivo en cuanto a capacidad de transmisión de información en un neurotransmisor «cargado» d e información. En el caso de las catecolaminas, actúa como precursor el aminoácido no esencial L-tirosina. La tirosina hidroxilasa es el paso limitante de la tasa de síntesis y virtualmente se satura por los niveles cerebrales de este aminoácido. Por tanto, el incremento de los niveles de este aminoácido en el cerebro no afectará significativamente la biosíntesis de las catecolaminas. Además, para prevenir un círculo vicioso de síntesis y de degradación de catecolaminas, la tirosina hidroxilasa está sujeta a un mecanismo de retroalimentación negativo regido por el producto final. De este modo, cuando la concentración de catecolaminas en la terminación nerviosa sobrepasa su capacidad de almacenamiento, el exceso de catecolaminas inhibe la actividad de la tirosina hidroxilasa, evitando que prosiga la síntesis de catecolaminas. Esta retroalimentación asegura que siempre exista una concentración constante de catecolaminas frente a la demanda de liberación de las mismas de la sinapsis. Por tanto, cuando las neuronas catecolaminérgicas no transmiten, la síntesis de catecolaminas se detiene. Por otra parte, cuando se liberan catecolaminas y se agotan las reservas, esta retroalimentación inhibidora desaparece y la síntesis se reanuda.
Se hace patente, sin embargo, que actúan también otros mecanismos durante los períodos de mayor demanda en la liberación de catecolaminas. Los «disparos» repetidos de la neurona catecolaminérgica producen la activación de sistemas de segundos mensajeros y por tanto de proteínas quinasas (ver más adelante). La fosforilación de la enzima tirosina hidroxilasa por las proteínas quinasas reduce su sensibilidad para la retroalimentación inhibidora e incrementa su afinidad por el cofactor crítico pterina (Nose et al., 1985). Los períodos de incremento prolongado de la actividad neuronal catecolaminérgica provocan la puesta en marcha de un segundo mecanismo, la síntesis de moléculas enzimáticas adicionales en la vía de biosíntesis de las catecolaminas. Este segundo proceso está regulado a nivel del soma de las neuronas catecolaminérgicas, donde el ARNm adicional codificado por la tirosina hidroxilasa es copiado a partir del ADN del núcleo. Así, se hace patente que la síntesis de catecolaminas está sometida a una regulación dinámica que, a su vez, está firmemente coordinada por la actividad eléctrica de la neurona catecolaminérgica. Después de que en el citosol del nervio terminal se haya producido la síntesis enzimática de las catecolaminas, estas sustancias se concentran en vesículas, pequeños sacos membranosos localizados en la terminación nerviosa. El almacenamiento vesicular es un proceso activo que requiere energía y que resulta inhibido irreversiblemente por el fármaco antihipertensivo reserpina. Las vesículas de almacenamiento cumplen dos funciones. Primero, protegen a las catecolaminas de ser degradadas por el enzima monoamino-oxidasa (MAO). Segundo, las vesículas influyen en la descarga cuántica de catecolaminas por liberación mediante exocitosis, cuando un potencial de acción llega al nervio terminal. Además de la enzima intraneuronal MAO, una segunda enzima que inactiva catecolaminas se encuentra en la superficie externa de la membrana neuronal, así como en la superficie externa de muchos otros tipos de neuronas. Esta enzima, catecolO-metiltransferasa (COMPT), cataliza la inactivación de las catecolaminas por metilación de uno de los grupos co/anillo hidroxil.
Sin embargo, la degradación enzimática no es el mecanismo más significativo por el cual se ter mina la acción de catecolaminas en la sinapsis. El mecanismo más crítico es una recaptación activa de las catecolaminas por la propia terminal nerviosa que las ha liberado. La recaptación se lleva a cabo gracias a una proteína transportadora específica que cambia las catecolaminas con un proceso dependiente de energía impulsado por el gradiente de sodio a través de la membrana neuronal (Pacholczyk et al., 1991). Los transportadores dopaminérgicos y la noradrenalina son miembros de una misma familia genética de proteínas que también incluye los transportadores serotoninérgicos y de GABA (ácido gama-aminobutírico) (Revisado por Giros y Caron, 1993).
NEUROPÉPTIDOS NEUROTRANSMISORES PUTATIVOS
Hormona adrenocorticotropa (ACTH)
Angiotensina II
*Beta-endorfina
Bombesina
Bradiquinina
Carnosina
Colecistoquinina
*Dinorfina
Factor liberador de corticotropina
Galinina
Gastrina
Glucagón
Hormona liberadora de tirotropina (TRH)
Insulina
*Leu-encefalina
*Met-encefalina
Neuropéptido γ
Neurotensina
Pancreostatina
Péptido natriurético auricular
Péptido relacionado con el gen de la calcitonina (CGRP)
Péptido vasoactivo intestinal (VIP)
Somatostatina
Sustancia P Vasopresina
* Miembros de la familia de las endorfinas.
Los procesos implicados en la síntesis, almacenamiento, liberación e inactivación de los neurotransmisores clásicos se resumen en la Figura 2. Estos procesos interrelacionados aseguran una disponibilidad estable del neurotransmisor en la terminal nerviosa, sea cual sea la demanda y la inactivación del neurotransmisor liberado, a fin de que no pueda difundirse fuera de la hendidura sináptica en cantidades significativas. Ha sido demostrada la operatividad de los mismos principios en un grado importante, aunque variable, para los otros neurotransmisores clásicos, incluyendo la serotonina, la acetilcolina y la histamina. Los neurotransmisores de tipo aminoácido, sin embargo, representan una excepción importante del principio de acuerdo con el que los neurotransmisores son sintetizados a partir de precursores neurofisiológicamente inactivos. El aminoácido glutamato parece ser el neurotransmisor excitador predominante en el cerebro; y los aminoácidos como el GABA (ácido gamma-aminobutírico), la glicina y posiblemente la taurina parecen ser los neurotransmisores inhibidores más destacables.
Estas moléculas están presentes en el plasma y son precursores importantes en la síntesis de proteínas. Estas características parecerían ser contradictorias con las de un neurotransmisor, que debe poseer una acción altamente localizada sobre los receptores apropiados. Sin embargo, se gasta una cantidad considerable de energía para mantener procesos de transporte selectivo y la acción de enzimas catabólicos, con el objeto de mantener concentraciones de estos neurotransmisores aminoácidos extremadamente bajas en el espacio extracelular del cerebro. La importancia de esta protección se ilustra por el hecho de que la concentración intracelular de ácido glutamático en ciertas regiones del cerebro es mayor de 10 mM, mientras que la concentración en el líquido cefalorraquídeo (CSF) es aproximadamente de 0,1 µM, lo que representa un gradiente 100.000 veces mayor.
Neuropéptidos
El hecho de que las proteínas pequeñas, como por ejemplo los péptidos, sean utilizadas en el cuerpo como señales, es bien conocido por su función como hormonas en la hipófisis y en varias glándulas endocrinas. El posible papel de los péptidos como neurotransmisores procede del descubrimiento de que los factores de liberación que controlan la secreción de diversas hormonas hipofisiarias fueran, de hecho, péptidos sintetizados por neuronas en el núcleo arqueado del hipotálamo. Sin embargo, el descubrimiento decisivo que provocó un amplio interés en relación con los péptidos como posibles neurotransmisores fue el hallazgo de las endorfinas, péptidos opiáceos endógenos, que se encuentran ampliamente distribuidos en el sistema nervioso central (SNC) (Hughes et al., 1975). Desde el descubrimiento de las endorfinas hace una década, el número de péptidos que se cree que actúan como neurotransmisores en el cerebro se ha incrementado considerablemente, y en la actualidad es superior a cuarenta.

La investigación de los neuropéptidos (para una revisión, ver Hokfelt, 1991) en la última década ha revelado varios principios generales. A diferencia de los pequeños neurotransmisores moleculares que se sintetizan por procesos enzimáticos localizados dentro de la terminal nerviosa, los neuropéptidos se sintetizan dentro del cuerpo neuronal (Figura 4). Esto refleja el hecho de que la síntesis de los neuropéptidos, que son pequeñas proteínas, se dirige por ARNm que ha sido transcrito del ADN nuclear. Los niveles de neuropéptidos en la terminal nerviosa dependen completamente de la síntesis, el procesamiento y el transporte de los péptidos del soma neuronal. Asimismo, parece que las neuronas peptidérgicas son menos propensas a responder rápidamente a aumentos prolongados en la liberación a causa del retraso en la síntesis y transporte de neuropéptidos suplementarios que deben llegar desde el soma neuronal.

Uno de los hallazgos más sorprendentes en relación a la síntesis de neuropéptidos es que un solo gen a menudo da lugar a múltiples péptidos activos y, además, que la gama de péptidos producidos por un solo gen puede variar en cuanto al tipo de neuronas. La diversidad empieza después de la transcripción del gen que codifica el precursor del péptido. En neuronas eucariotas la mayoría de genes tienen sus secuencias codificadas de proteínas (llamados *exones) interrumpidas por secuencias no-codificadas (llamadas *itrones). Cuando se transcribe un gen, la transcripción principal es co-lineal con el ADN y por tanto contiene *exones e *itrones. Antes de que el ARN parta del núcleo para ser traducido, los *itrones se expulsan y los *exones se parten para formar el ARNm. Se ha visto que la primera transcripción de ciertos genes neuropéptidos se parte de maneras distintas en diferentes tipos de neuronas. Al incluir o excluir exones concretos en el ARNm citoplásmico, se pueden producir péptidos de ARNm con diferentes codificaciones. Por ejemplo, los péptidos calcitronin y CGRP son productos del mismo gen derivado de esta división alternativa. La codificación de neuropéptidos maduros de ARNm se traduce, en el retículo endoplasmático rugoso para producir precursores grandes llamados poliproteínas. Estos precursores (es decir, pre-proopiomelanocortina o pre-proencefalina) contienen una secuencia, casi siempre en el terminus de amino de la proteína, que dirige la proteína por la vía secretoria de la neurona. Esta secuencia líder o pre-secuencia se parte rápidamente por una endopeptidasa y deja el resto del precursor (pre-proopiamelano cortina o pre-proencefalina). Este precursor lleva a cabo más partición proteolítica y por lo tanto químicamente modificada (es decir, glicosilación, amidación, acetilación o fosforilación) dentro del retículo endoplasmático rugoso y el aparato de Golgi para ceder numerosos péptidos biológicos activos para liberar.
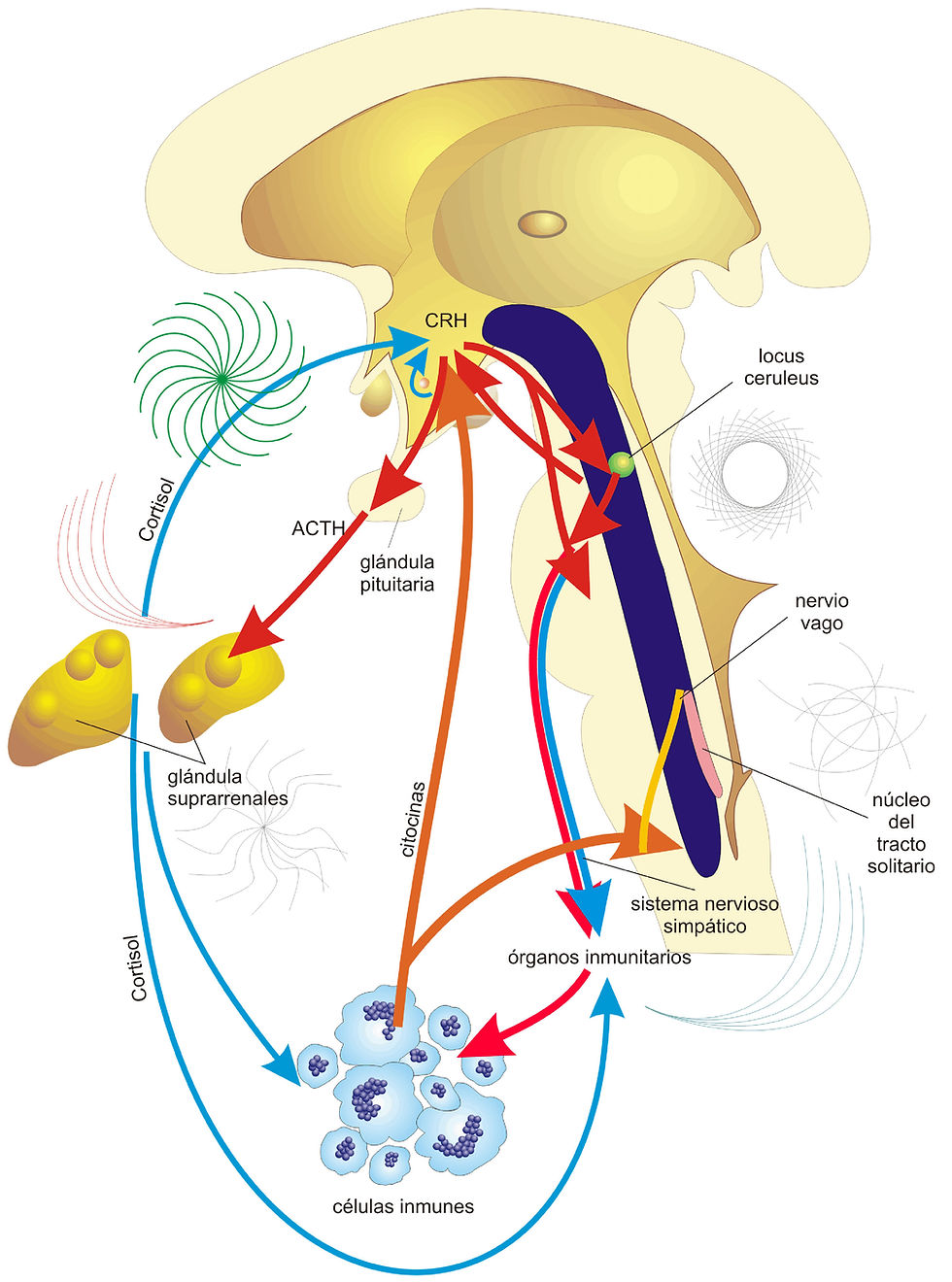
Así como la división alternativa de ARNm permite la regeneración de múltiples moléculas de estimulación a partir de un solo gen, el procesamiento diferencial de los precursores de péptidos permite la regeneración de múltiples moléculas de estimulación de un mismo péptido precursor. Dentro de los péptidos precursores, hay pares de residuos de aminoácidos básicos (lisina o arginina) reconocidos por los enzimas procesadores como zonas de división. La familia de enzimas responsable de procesar dentro de las neuronas mamíferas ha sido descubierta recientemente y por tanto no están completamente caracterizadas. Sin embargo, parece ser que ciertas enzimas tienen mayor afinidad por algunos pares de residuos dibásicos que por otros. Por tanto, dependiendo de los enzimas que se expresan en un tipo neuronal particular o endocrino, los precursores grandes pueden ser divididos en diferentes péptidos activos con diferentes papeles fisiológicos. Entre los neurotransmisores péptidos, los péptidos opiáceos endógenos son los más estudiados y tienen una clara relevancia para la psiquiatría debido a su papel en la respuesta al estrés, en las conductas motivadas y en la analgesia.
Hughes et al. (1975) identificaron los primeros opiáceos endógenos met y leu encefalina. Desde entonces, se han aislado y caracterizado aproximadamente 20 péptidos opiáceos activos de cerebros de mamíferos y de glándulas pituitarias y adrenales. Todos estos opiáceos endógenos contienen los mismos cuatro aminoácidos cuyo grupo amino terminal es TirGli-Gli-Fe, seguidos por Met o Leu (Met-encefalina, Leu-encefalina). Todos los péptidos opiáceos derivan de uno de tres grandes precursores poliproteínicos, cada uno codificado en un gen separado. Los precursores son la pro-encefalina (que tiene codificadas seis copias de la secuencia de Met-encefalina y una de las secuencias de Leu-encefalina), la prodinorfina (que es el precursor de la *d inorfina opiácea endógena y péptidos relacionados) y la pro-opiomelanocortina. La pro-opiomelanocortina (POMC) es particularmente interesante porque contiene las secuencias de péptidos activos con funciones biológicas aparentemente diferentes, el péptido opiáceo beta-endorfina y el no-opiáceo, la hormona adrenocorticotropa (ACTH), y porque se procesa para producir diferentes tejidos (Figura 4. En el lóbulo anterior de la pituitaria, sólo un subgrupo de las zonas de división dibásicas dentro de la pro-opiomelanocortina es reconocido por la enzima que está presente. En este tejido, el precursor produce un péptido terminal-N de función biológica desconocida junto con ACTH y la hormona beta-lipotropina. La beta-lipotropina se somete a otra división para procesar el péptido opiáceo betaendorfina. Por tanto, cuando la ACTH es liberada por la glándula pituitaria, las beta-endorfinas también son liberadas. Muchos mamíferos (pero no los humanos) tienen un lóbulo pituitario intermedio que contiene una enzima procesadora adicional. En el lóbulo intermedio, la ACTH se somete a otra división para procesar un péptido llamado péptido del lóbulo intermedio tipo corticotropina (CLIP) y la hormona melanocito estimulante (MSH). Este proceso, sin embargo, no ocurre en los humanos.

Co-localización
Antes se creía que cada neurona usa un neurotransmisor, y sólo uno. Sin embargo, en los últimos años se ha asistido a un rápido crecimiento de la lista de excepciones a este principio, y se ha demostrado que las neuronas contienen y liberan más de un neurotransmisor. Generalmente, la demostración de la co-localización de dos o más neurotransmisores en la neurona, comporta que uno de ellos sea un neurotransmisor clásico y el otro un neuropéptido. Pero además en la actualidad existen ejemplos en los que dos neurotransmisores clásicos, como la serotonina y el GABA, coexisten en la misma neurona. Es importante entender que los mismos neurotransmisores no están co-localizados. Por ejemplo, se ha demostrado que la encefalina, péptido opiáceo, está co-localizado en determinadas neuronas noradrenérgicas del sistema nervioso simpático y en algunas neuronas serotoninérgicas del cerebro. Se ha demostrado también que en el cerebro la *colescistocinina está co-localizada en las neuronas dopaminérgicas que inervan el sistema corticolímbico, pero no en las neuronas dopaminérgicas que inervan el estriado. Con el gran número de neurotransmisores putativos en el cerebro, el número de posibles combinaciones es inmenso y sugiere un grado mucho mayor de complejidad en la neurotransmisión sináptica del que había sido considerado con anterioridad. Los mecanismos claramente diferenciados implicados en la síntesis de los neuropéptidos comparados con los de los neurotransmisores clásicos sugieren que los neurotransmisores co-localizados pueden desempeñar funciones algo diferentes, pero complementarias. Algunos estudios sugieren que los neuropéptidos se liberan sólo durante los períodos de marcada actividad neuronal, mientras que los neurotransmisores clásicos se liberan en proporción al flujo de los impulsos. Sin embargo, actualmente la comprensión de los mecanismos implicados en la comunicación compartida continúa siendo rudimentaria.
RECEPTORES
La identificación, caracterización y, más recientemente, la cenificación molecular de los receptores de los neurotransmisores, constituyen un gran avance en la neurociencia, produciendo un impacto considerable en la comprensión de la elaboración de información en el cerebro y los lugares de acción de las sustancias neuroactivas, incluyendo los fármacos psicotrópicos. Aunque habitualmente los neurotransmisores son descritos como excitadores o inhibidores, como si esta acción fuese inherente a su estructura molecular, la naturaleza de la respuesta neuronal a un neurotransmisor depende en último término de la presencia de un receptor unido a un transductor. Dependiendo del tipo de receptor-transductor que posea una neurona dada, un neurotransmisor puede ejercer efectos inhibidores, excitadores o moduladores.
Los receptores neuronales son proteínas situadas en la superficie externa de la membrana neuronal. Estas proteínas tienen regiones de fijación del ligando accesibles a los mensajeros extra-celulares y a otras regiones involucradas en la transducción de la interacción de unión a un efecto intercelular. La unión reversible del neurotransmisor con la zona de reconocimiento del receptor causa un cambio de conformación que desencadena la posibilidad de que la membrana sea atravesada. Este hecho puede implicar la apertura de los canales iónicos que atraviesan la membrana neuronal o la activación de una proteína-G estimuladora de transducción (ver más adelante) que se asocia a la superficie interna de la membrana. Los receptores que actúan de vía de entrada en un canal iónico intrínsico se llaman canales ligand-gated; los receptores que actúan vía las proteínas-G se llaman receptores proteínas-G linked. Como en el caso de otros tipos importantes de moléculas mencionadas anteriormente en este capítulo, como los canales iónicos sensibles al voltaje y los transportadores de neurotransmisores, los canales ligand-gated, los receptores pro-lin-G y las proteínas-G forman grandes familias independientes de moléculas con estructuras homólogas. Se cree que cada una de estas familias de genes empezó con un único predecesor primitivo (es decir, un canal ligand-gatedancestral ) que, después de duplicaciones y mutaciones de genes dio lugar a un gran número de genes y por tanto a proteínas con funciones específicas pero relacionadas, permitiendo una complejidad creciente de estimulación neuronal durante la evolución.
La fijación del ligando
Puesto que los receptores se unen con el neurotransmisor con el que interaccionan, de forma ávida, específica, reversible y saturable (por ejemplo, el número de zonas receptoras está limitado), los neurocientíficos han aprovechado estas características al utilizar ligandos radioactivos para marcar los receptores de una manera específica. Si la avidez de la interacción específica entre el ligando marcado radioactivamente es suficientemente alta, dicho ligando puede quedar «atrapado» en el receptor de forma lo bastante intensa como para que el complejo radioactivo resultante pueda ser aislado. Esta estrategia ha facilitado enormemente los estudios orientados a examinar las características de estas interacciones entre receptor y neurotransmisor y su localización en el sistema nervioso. Por ejemplo, la afinidad relativa entre los fármacos o sustancias parecidas a los neurotransmisores y al receptor, puede determinarse midiendo su potencia para la unión de un ligando radioactivo con su receptor. Con este método, Snyder y sus colaboradores demostraron una correlación precisa entre las afinidades de los fármacos antipsicóticos con los receptores dopamínicos tipo D2 y la potencia clínica de estos fármacos en el tratamiento de trastornos psicóticos (Figura 5). Los métodos de fijación del ligando combinados con modelos tridimensionales de receptores clonados deberían facilitar una comprensión de la estructura precisa de las moléculas requeridas para un reconocimiento óptimo en la zona del receptor y, por tanto, a la larga, un diseño farmacológico racional. Como ciertos radioligandos se unen estrechamente a sus receptores específicos, ha sido posible visualizar la distribución de los receptores en el cerebro mediante técnicas autorradiográficas. Con este método, cortes finos de tejido cerebral son incubados con el ligando radioactivo en un tampón fisiológico. A continuación, el corte se lava con un tampón libre de radioligando para eliminar la parte de éste unida de forma no específica y laxa, que es fácil y rápidamente reversible. En el tejido queda el radioligando específicamente asociado con el receptor. Esta asociación puede entonces ser revelada por aposición del corte del tejido con una película sensible a los rayos X, con lo que se produce la precipitación de los gránulos de plata de la emulsión de la fotografía en aquellas zonas donde están situados los ligandos radioactivos. La Figura 1-7 presenta un autorradiografía de la distribución de los receptores muscarínicos evaluados por la fijación del antaponista muscarínico 3H específico y muy potente denominado quinuclidinil benzilato en una sección parasagital del cerebro de mono.



Comentarios