Estimulación cognitiva dirigida a los receptores oligodendrocitos para la producción de mielina
- Consejo Mexicano Neurociencias

- 24 oct 2022
- 20 Min. de lectura

Autores: Jordana Mariane Neyra Chauca, Maritza del Carmen Mudarra Vergara
Resumen
En los últimos años la estimulación cognitiva ha ido adquiriendo más importancia en las personas con algún tipo de deterioro cognitivo leve. Pero ahora sabemos que la estimulación cognitiva puede tener un impacto en los receptores oligogendrociticos con la ayuda de neurotransmisores que ocasionaran la producción de mielina. (1, 3)
Objetivo: Conocer el impacto de los mecanismos que pueden vincular los cambios en la actividad neuronal por medio de la estimulación cognitiva con la posterior regulación de la mielinización.
Metodología: Se realizó una revisión bibliográfica, por medio de una investigación sistemática en la que se evaluaron un total de 53 bibliografías, entre libros y artículos.
La búsqueda se llevó a cabo en artículos con fechas del 2010 al 2022, realizando la búsqueda a través de las siguientes bases de datos: ClinicalKey, Pubmed, Springer, New England, Imbiomed, Neuron, Elsevier, NCBI, Scielo y Revista de Neurología.
Marco teórico: Los cambios en la actividad neuronal podrían ser la base de gran parte de la interacción entre las experiencias conductuales y los cambios en las células del linaje de los oligodendrocitos, ya que los estudios que nos hemos encargado de correlacionar han demostrado que la actividad neuronal puede impulsar la oligodendrogénesis e incluso la propia mielinización. (22, 33, 40)
Resultados: La supresión condicional de gen Myrf en las OPC (células precursoras de oligodendrocitos), impide la diferenciación de OPCs. (22,32) Por lo que se traduce en que la oligodendrogénesis es necesaria para el aprendizaje motor. (33)
Discusión:
Durante esta investigación se ha determinado que la capacidad del cerebro para adaptarse a la experiencia es la clave del aprendizaje y la memoria. El mapeo genético del destino y las imágenes in vivo han revelado que las células del linaje de oligodendrocitos y las vainas de mielina que producen cambian continuamente a lo largo de la vida de un animal. Combinado con la observación de que muchos axones en la neocorteza. (25)
Conclusión: Es importante saber que hay muchos aspectos que se unen para consolidar la importancia de la estimulación cognitiva en la producción de mielina, ya que las neuronas trabajan con los oligogendrocitos para la producción de mielina y al estimular las neuronas o algunos tipos de receptores oligogendrocíticos, se puede aumentar y reparar la producción de mielina.
Palabras clave: neurotransmisores, desmielinización, neuronas, ejercicio aeróbico, conductas, emociones.
Introducción
La estimulación cognitiva, engloba todas aquellas actividades que se dirigen a mejorar el funcionamiento cognitivo en general (memoria, lenguaje, atención, concentración, razonamiento, abstracción, operaciones aritméticas y praxias) por medio de programas de estimulación. (2) Pero en los últimos años con los avances de las neurociencias, esta estimulación cognitiva puede llegar a ser enfocada de manera más específica a la estimulación de algunas zonas cerebrales. Cada vez hay más pruebas de que la experiencia regula la mielinización del SNC.(13,16) Por ejemplo, se ha demostrado que las interacciones sociales, la estimulación sensorial y varias formas de aprendizaje alteran la materia blanca y la estructura de la mielina tanto en humanos como en modelos animales.(1,3) A nivel de neuronas y axones individuales, aumentar el nivel de actividad mediante el uso de optogenética o quimiogenética mejora la generación de oligodendrocitos formadores de mielina y aumenta la cantidad de mielina que forman, mientras que la prevención de la liberación vesicular sináptica de los axones reduce la formación de mielina Juntos, estos hallazgos han llevado a un nuevo concepto de plasticidad del SNC: la mielinización adaptativa. Este concepto postula que los cambios en la actividad neuronal en respuesta a la experiencia del entorno extrínseco conducen a cambios locales en la mielinización. Dichos cambios podrían, a su vez, contribuir a las alteraciones en la conducción que sustentan la plasticidad del circuito neural del SNC. (3,4)
Antecedentes
Durante mucho tiempo se ha considerado que la capacidad del cerebro para adaptarse a la experiencia es la clave del aprendizaje y la memoria. Informes recientes de cambios en la mielinización inducidos por la experiencia han introducido el concepto de mielinización como una forma adicional de plasticidad que podría mediar cambios duraderos en la función del circuito neural. (12,15) Aunque históricamente la mielina se ha considerado una característica estructuralmente permanente que sirve para aumentar la conductancia axonal, el mapeo genético del destino y las imágenes in vivo han revelado que las células del linaje de oligodendrocitos y las vainas de mielina que producen cambian continuamente a lo largo de la vida de un animal. Combinado con la observación de que muchos axones en la neocorteza de los mamíferos permanecen parcialmente mielinizados en la edad adulta, estos estudios indican que, en lugar de alcanzar un punto de saturación preprogramado, existe una gran ventana dentro de la cual los factores externos podrían influir en la tasa y el patrón de mielinización en el cerebro. De hecho, ahora hay evidencia considerable de que manipular la
experiencia sensorial o la actividad neuronal puede afectar la proliferación y diferenciación de las células del linaje de oligodendrocitos en roedores. (7,11,14)
Marco teórico
Debemos comprender que la estimulación cognitiva consiste un conjunto de actividades dirigidas a mantener o a perfeccionar el funcionamiento cognitivo en general, a través de ejercicios de memoria, percepción, atención, concentración, lenguaje, funciones ejecutivas como: solución de problemas, planificación, razonamiento y control. Praxias y funciones viso espaciales, mediante programas estructurados de estimulación. (9, 22)
Trabajos recientes muestran que los cambios en la actividad neuronal pueden modular la proliferación, la diferenciación y la mielinización para apoyar la formación y el funcionamiento de los circuitos neuronales.
Si bien la oligodendroglia expresa una colección diversa de receptores para factores de crecimiento, moléculas de señalización, neurotransmisores y neuromoduladores, nuestro conocimiento de las vías de señalización intracelular que están reguladas por la actividad neuronal sigue siendo en gran medida incompleto. Muchas de las vías que modulan el comportamiento de la oligodendroglia para la producción de mielina. (6,5, 12)
Neurotransmisores y otras moléculas de señalización
¿Las células del linaje de oligodendrocitos detectan y responden a otras moléculas de señalización además de las de las sinapsis? Esta pregunta es de suma importancia, ya que los oligodendrocitos se han conocido por ser el soporte glial de las neuronas y por lo tanto conocer su linaje que responde a la sinapsis nos pueden ayudar a estimularlos a través de las neuronas por medio de la sinapsis. (7)
Los precursores de oligodendrocitos expresan una amplia gama de neurotransmisores y receptores de ligandos neuroactivos. Además de los receptores de neurotransmisores para aminoácidos (glutamato y GABA), las OPC expresan receptores para otros neuromoduladores (ATP, acetilcolina, histamina, norepinefrina, serotonina, dopamina) y neuropéptidos (sustancia P, angiotensina II, bradicinina). La activación de estos receptores en OPC provoca la señalización de calcio intracelular, lo que sugiere que la oligodendroglia puede detectar y responder a numerosas señales dependientes de la actividad neuronal. Dado que este tema ha sido ampliamente revisado previamente, solo describiremos brevemente cómo estas moléculas de señalización afectan a la oligodendroglia. (8, 15)
Neurotransmisores selectos para inducir la producción de mielina
Los neurotransmisores son buenos candidatos para contribuir a los cambios dependientes de la experiencia en las células del linaje de oligodendrocitos. Los OPC expresan receptores funcionales de glutamato (AMPA y NMDA) y GABA, así como receptores para otros tipos de transmisores incluidos los receptores purinérgicos. (28) Varias investigaciones han sugerido que los aumentos en determinados neurotransmisores pueden tener efectos específicos de la región sobre la oligodendrogénesis. Por ejemplo, se ha demostrado que los tratamientos con levodopa aumentan el número de células positivas para NG2 recién nacidas en la sustancia negra después de lesiones dopaminérgicas, donde se sabe que el enriquecimiento ambiental mejora el daño. Los oligodendrocitos CNPasa positivos también expresan receptores de dopamina, y se ha encontrado que los agonistas D2 y D3 previenen la lesión de los oligodendrocitos causada por el estrés oxidativo del glutamato o la privación de glucosa/oxígeno en modelos de cultivo. (23)
Además, la transmisión de glutamato también puede ser importante para impulsar los efectos dependientes de la experiencia conductual en el desarrollo celular del linaje de oligodendrocitos. De acuerdo con esta idea, los ratones que carecen de una subunidad crítica del receptor NMDA no muestran aumentos relacionados con el ejercicio en la neurogénesis dentro del hipocampo.(52)
Interacciones neurona-oligodendroglia
Trabajos recientes muestran que los cambios en la actividad neuronal pueden modular la proliferación, la diferenciación y la mielinización para apoyar la formación y el funcionamiento de los circuitos neuronales. Si bien la oligodendroglia expresa una colección diversa de receptores para factores de crecimiento, moléculas de señalización, neurotransmisores y neuromoduladores, nuestro conocimiento de las vías de señalización intracelular que están reguladas por la actividad neuronal sigue siendo en gran medida incompleto. (20, 38) Muchas de las vías que modulan el comportamiento de la oligodendroglia están impulsadas por cambios en la señalización del calcio intracelular, que pueden afectar de manera diferente la dinámica del citoesqueleto, la expresión génica, la maduración, la integración y el soporte axonal. Adicionalmente, La comunicación neurona-oligodendroglia dependiente de la actividad juega un papel integral en la recuperación de las lesiones desmielinizantes. En esta revisión, resumimos las modalidades de comunicación entre las neuronas y la oligodendroglia y exploramos los posibles roles de la señalización del calcio dependiente de la actividad en la mediación del comportamiento celular y la mielinización. (18)
Neuronas, estimulación y mielina: sinergismo
Los cambios en la actividad neuronal podrían ser la base de gran parte de la interacción entre las experiencias conductuales y los cambios en las células del linaje de los oligodendrocitos, ya que los estudios han demostrado que la actividad neuronal puede impulsar la oligodendrogénesis e incluso la propia mielinización.
La disfunción de las interneuronas parvalbuminérgicas puede ser el resultado de una alteración de la plasticidad de la mielina. Las interneuronas parvalbuminérgicas de pico rápido son esenciales para generar oscilaciones corticales en el rango gamma (30-120 Hz), mediadas por la inhibición sincronizada de las neuronas piramidales. A través de la inhibición perisomática rítmica de las neuronas piramidales, los conjuntos sincrónicos de interneuronas parvalbuminérgicas evocan oscilaciones gamma de alta frecuencia en la corteza y el hipocampo. (47) Estas oscilaciones gamma pueden determinarse mediante registros electroencefalográficos (EEG). En SZ, las oscilaciones gamma disfuncionales son la base de los déficits en las funciones cognitivas, como la atención y la memoria de trabajo. La maduración deteriorada de las oscilaciones gamma relacionadas con las interneuronas puede ser un vínculo fundamental entre los déficits cognitivos y de memoria asociados con el estrés de la vida temprana y las etiologías de SZ, que se basan en un neurodesarrollo aberrante (43)
Impacto de la estimulación cognitiva en la mielinización
Se ha demostrado que la mielinización del cerebro depende de las experiencias, y se ha propuesto que las alteraciones del neurodesarrollo relacionadas con el estrés en la mielinización dependiente de la experiencia social desempeñan un papel en la SZ. El modelo de ratón de aislamiento social inmediatamente después del destete (día posnatal 21-50) se presenta con un déficit en la morfología de los oligodendrocitos, espesor de mielina reducido, expresión disminuida de MBP y MAG, un déficit en el comportamiento relacionado con SZ (PPI, memoria de trabajo) y disminución exploración social. Es importante destacar que, en contraste con los efectos del aislamiento social adulto, este fenotipo inducido temprano no podría ser rescatado por una reintegración social posterior. En ratones adultos expuestos al aislamiento social, la clemastina, un antagonista de los receptores muscarínicos, mejoró la diferenciación y mielinización de los oligodendrocitos y mejoró el comportamiento de evitación social. (13, 26) El entrenamiento modula dinámicamente las células del linaje de oligodendrocitos y la mielinización, entonces para determinar la dinámica de los oligodendrocitos, la mielina y las OPC durante el aprendizaje, se utilizaron imágenes longitudinales in vivo de dos fotones en la región de la extremidad anterior de la corteza motora durante el aprendizaje y el ensayo de una tarea de alcance de la extremidad anterior contralateral de una sola pastilla. Utilizaron ratones transgénicos que expresan EGFP en todos los oligodendrocitos mielinizantes corticales y vainas de mielina (MOBP-EGFP) para examinar los efectos del aprendizaje sobre la oligodendrogénesis y la remodelación de la vaina de mielina preexistente en ratones sanos. Las imágenes in vivo a largo plazo de las capas I-III nos permitieron rastrear ~ 100 oligodendrocitos y sus vainas de mielina en el transcurso de 2 a 3 meses por ratón. La inmunohistoquímica, las imágenes SCoRe in vivo y el rastreo semiautomático confirmaron que EGFP en ratones transgénicos MOBP-EGFP refleja fielmente la presencia y la longitud de las vainas de mielina y permite la reconstrucción morfológica de oligodendrocitos individuales.
Suponiendo un rango de 45 ± 4 vainas por oligodendrocitos corticales, el muestreo promedio fue del 67 al 74 % de un árbol de oligodendrocitos individuales. (36) Curiosamente, la creciente evidencia indica que el ejercicio aeróbico aumenta el volumen del hipocampo y mejora la cognición en pacientes con SZ. Estudios previos mostraron que los efectos del ejercicio en el hipocampo podrían estar relacionados con la carga poligénica de las variantes de riesgo de SZ. (32) Recientemente se evaluó el papel modulador de las puntuaciones de riesgo poligénico (PRS) SZ específicas del tipo de célula en los cambios de volumen inducidos por el ejercicio en los subcampos CA1, CA2/3 y CA4/giro dentado. Estos análisis mostraron que la carga poligénica asociada con las células precursoras de oligodendrocitos y la glía radial influyó significativamente en los cambios de volumen entre el inicio y los tres meses en el subcampo CA4/giro dentado en pacientes con SZ que realizan entrenamiento de resistencia. Una mayor carga de riesgo genético asociada con células precursoras (22) de oligodendrocitos o RG se asoció con un aumento de volumen menos pronunciado o incluso una disminución en CA4/circunvolución dentada durante la intervención de ejercicio. Por lo tanto, se planteó la hipótesis de que el riesgo poligénico específico del tipo de células SZ modula los procesos neuroplásticos inducidos por el ejercicio aeróbico en CA4/giro dentado del hipocampo. (53)
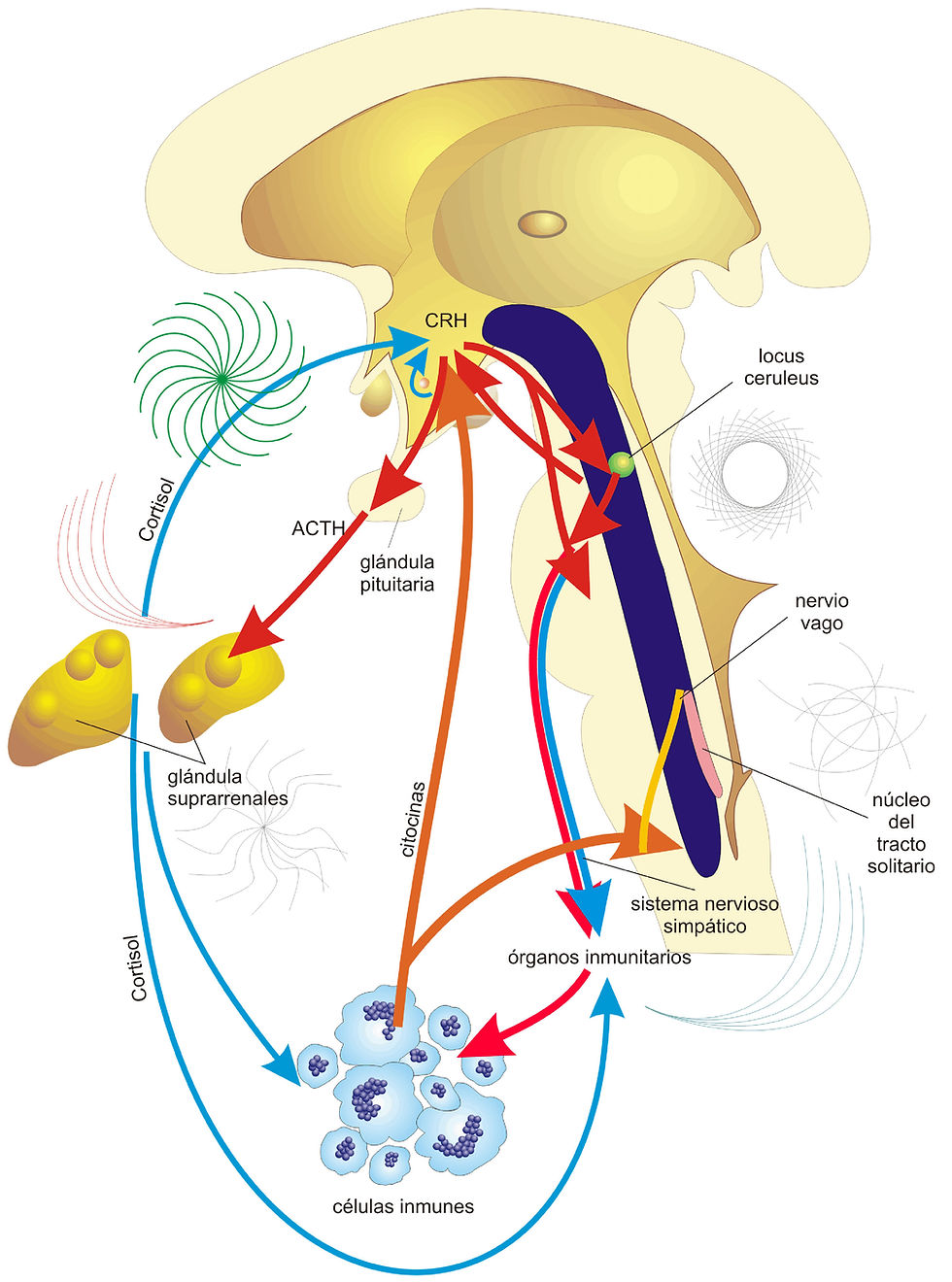
También se sabe que el estrés intermedio las experiencias conductuales mencionadas anteriormente desempeñan un papel en la modulación del estrés. (51) Aunque generalmente se cree que el enriquecimiento ambiental y el ejercicio voluntario atenúan los efectos negativos del estrés, se ha demostrado que el aislamiento social aumenta los efectos negativos del estrés, en particular a través del eje hipotálamo-hipófisis-suprarrenal y a través de la liberación de hormonas del estrés, incluidas la corticosterona y otros glucocorticoides. Sin embargo, el ejercicio en sí mismo es un estresor fisiológico leve y, como tal, inicialmente estimula los sistemas canónicos relacionados con el estrés, pero se diferencia de las respuestas de estrés evocadas por estímulos aversivos mediante el uso de mecanismos que incluyen la reducción de las afinidades de unión de los receptores de corticosterona. Esto es relevante ya que se ha demostrado que las vías de corticosterona totalmente activadas (en ausencia de moduladores como el ejercicio) inhiben tanto la génesis como la neurogénesis de las células endoteliales en la PFC y el hipocampo. (38)
Dentro de las formas para un mejor abordaje sobre la estimulación cognitiva y lograr el evitar el deterioro y desmielinización temprana de las células oligodendrocíticas se encuentran:
Antioxidantes y estimulación cognitiva
Para conseguir regenerar la mielina, los investigadores han tenido que comprender cómo funciona este proceso; para poder después comprobar que una proteína en concreto, denominada eEF1A1, es responsable de bloquear el proceso de remielinización. (19, 21) Por lo tanto, desactivando esta proteína se consigue que las neuronas recuperen la mielina. Estos resultados son esperanzadores para todos los afectados de esclerosis múltiple.
Estrés en forma de abuso
Los estudios epidemiológicos han demostrado que la exposición temprana al estrés en forma de abuso y negligencia en la infancia aumenta el riesgo de desarrollo posterior de SZ. (34) Se sabe que el abuso y la negligencia infantil tienen una influencia negativa en la cognición en pacientes con SZ. Sin embargo, hasta la fecha, no existe un tratamiento específico para los déficits cognitivos relacionados con SZ, los síntomas negativos y los déficits subyacentes de mielinización y oligodendrocitos. (17)

Evaluación Neuropsicológica
La batería de pruebas neuropsicológicas incluía una serie de tareas estandarizadas y experimentales que se completaban en un orden fijo, con una duración media de 60 min. Todas las tareas se describen a continuación en detalle. Personal capacitado, que desconocía las asignaciones de intervención de los pacientes, administró las pruebas neuropsicológicas. El mismo evaluador administró todas las evaluaciones (línea de base, post-prueba y seguimiento) para cada sujeto individual para minimizar el sesgo. Los efectos de transferencia lejana se evaluaron con una tarea de razonamiento lógico no verbal, así como con tareas de atención y memoria. Los efectos de transferencia cercana se evaluaron con tareas ejecutivas que eran diferentes de las tareas de entrenamiento. (23, 24)
Control inhibitorio (falsas alarmas)
Para evaluar los cambios en el control inhibitorio, usamos una tarea computarizada Go/Nogo programada en Matlab que se usó previamente. Se pidió a los participantes que respondieran a una carta objetivo ubicada en el centro que aparecía en una pantalla. Ante la presentación de las letras X (Go) u O (Nogo) debían presionar las teclas de respuesta respectivas lo más rápido posible. Las letras eran blancas sobre fondo negro y el tamaño de los estímulos era de 0,7 por 0,7 cm. Cada estímulo se mostró durante 100 ms seguido de un intervalo aleatorio entre pruebas de entre 1000 y 2000 ms. Los estímulos se presentaron aleatoriamente en tres bloques de 150 ensayos y consistieron en un 70 % de ensayos Go y un 30 % de ensayos NoGo. Se instruyó a los sujetos para que respondieran lo más rápido posible con el dedo índice de la mano dominante. (40, 41)
Memoria de trabajo
Utilizamos una tarea computarizada (Matlab) para examinar la memoria de trabajo espacial. La tarea midió la precisión, lo que proporciona una medida más sensible de la capacidad de la memoria de trabajo que las tareas de extensión tradicionales. Los estímulos eran barras de colores orientadas aleatoriamente ubicadas en el centro sobre un fondo gris y siempre diferían al menos 10° en la orientación de la barra anterior. (42, 48) En esta tarea de memoria de trabajo de 4 elementos (carga alta) se presentaron cuatro barras de color y orientación aleatorios. Antes de cada bloque, se instruyó a los participantes para que recordaran la orientación de todas las barras. Después de que se presentaron las cuatro barras de estímulo, se presentó una barra de prueba de cualquiera de los colores presentados anteriormente después de un retraso de 500 ms. Se pidió a los participantes que giraran la barra de la sonda a la orientación de la barra del mismo color de memoria. Antes de comenzar la tarea principal, los participantes practicaron (30 intentos cada uno). La tarea principal incluía dos bloques de 30 ensayos, por lo que los participantes completaron 60 ensayos. Para cada elemento, el rendimiento de recuperación se definió como la diferencia entre el objetivo y los ángulos enviados. La precisión se calculó como la desviación estándar circular de la respuesta de error, mostrando una variabilidad reducida una mayor precisión general. Por lo tanto, la precisión se da en 1/radian. (45)
Atención (tiempo de reacción)
Aquí se evalua el tiempo de reacción con una versión de la prueba de la red de atención (ANT). Los detalles de esta tarea se describen en otra parte. Los estímulos se presentaron a través del software E-prime en un monitor de 17″, los tonos de alerta se presentaron a través de auriculares.
Fluidez verbal (semántica y fonémica)
En esta tarea, se le pide a las personas que produjeran oralmente tantas palabras como fuera posible en 2 minutos comenzando con una letra específica (S, F o A) o de una categoría específica (fruta, animales o ropa). Las condiciones se aleatorizaron entre las visitas. (25, 32)
Memoria a corto plazo y memoria de trabajo
Se utilizaron tareas de extensión de dígitos (longitud de extensión hacia adelante y hacia atrás) de la Escala revisada de inteligencia para adultos de Wechsler, así como tapping hacia adelante y hacia atrás para evaluar la memoria a corto plazo verbal y visuoespacial y la memoria de trabajo. (29, 30, 35)
Razonamiento lógico no verbal
Las matrices de Sandia superan el problema de un número limitado de estímulos al brindar la opción de elegir entre un grupo de ~3000 matrices, obtenidas mediante la combinación de diferentes características del estímulo, como forma, color y orientación. (47, 51) Se eligieron matrices experimentales de cuatro clases diferentes según el tipo y el número de operaciones analógicas requeridas para una solución correcta (relaciones de 1, 2 y 3 y matrices lógicas) y se combinaron en términos de dificultad para un conjunto de tres pruebas paralelas. Versiones que se aleatorizaron en puntos temporales. A los participantes se les dieron cuatro pruebas de práctica antes de comenzar la tarea real que requería que resolvieran tantas matrices como fuera posible en 15 minutos. Esta tarea que mide los efectos de transferencia lejana se definió como el resultado primario.
Como se ha examinado en profundidad, la relación entre las experiencias conductuales y los cambios inducidos por la actividad neuronal en el linaje de oligodendrocitos, ha sido un competidor principal durante muchos años para explicar cómo las experiencias influyen en el desarrollo del mismo. (10, 17)
Conclusión
La estimulación cognitiva (EC) abarca todas aquellas actividades dirigidas a estimular y mantener las capacidades cognitivas existentes. La atención, la memoria, el lenguaje, las funciones ejecutivas, las praxias, las gnosias son, entre otros procesos neuropsicológicos, susceptibles de ser estimulados y potenciados mediante técnicas de EC. Se ha constatado la importancia de una adecuada estimulación para el cerebro, ya que permite mejorar la calidad de vida de la persona y varios puntos abordados por este trabajo también nos señalan que puede ser utilizada para la estimulación de oligodendrocitos en la producción de mielina. Esta mejora se produce gracias a la obtención de objetivos más específicos, tales como el mantenimiento de las capacidades mentales el máximo tiempo posible, la potenciación de la autonomía y la autoestima de la persona, la mejora de la interacción de esta con su entorno y la disminución de la ansiedad y la confusión, así como otras reacciones psicológicas adversas.
Algunos receptores de oligogendrocitos tienen funciones importantes y específicas, es por eso que algunos están involucrados en la producción de mielina, pero otros de la conservación de oligogendrocitos por su relación de trabajo con las neuronas, por lo que se ha informado una reducción de oligodendrocitos perineuronales en la materia gris de la corteza prefrontal en pacientes con enfermedades degenerativas (ED).
Las evaluaciones anteriores que se utilizaron en el rastreo del linaje celular y los marcadores específicos en cada etapa indican que el aprendizaje motor aumenta rápidamente la oligodendrogénesis adulta, pero la dinámica de la mielinización dependiente de la actividad sigue sin estar clara debido al etiquetado incompleto de las poblaciones de OPC que se diferencian y la variabilidad interindividual en la sección transversal.
Fuentes bibliográficas
1. Ropper A.H., & Samuels M.A., & Klein J.P., & Prasad S(Eds.), (2020). Adams y Victor. Principios de neurología, 11e. McGraw Hill. https://accessmedicina.mhmedical.com/content.aspx?bookid=2942§ionid=246753213
2. Berkowitz A.L.(Ed.), (2020). Neurología clínica y neuroanatomía. Un enfoque basado en la localización. McGraw Hill. https://accessmedicina.mhmedical.com/content.aspx?bookid=2923§ionid=245014981
3. Kumar, V., Abbas, A., Aster, J. R. Y., & Cotran Patología Estructural, Y. Funcional. 9na Edición. España: Elservier; 2015.
4. Fauci, AS, Braunwald, E., Kasper, DL, Hauser, SL y Longo, DL (2010). Harrison manual de medicina . McGraw Hill Educación.
5. Cecil, RLF, Goldman, L. y Schafer, AI (2012). Goldman's Cecil Medicine, Expert Consult Premium Edition - Funciones e impresión en línea mejoradas, volumen único, 24: Goldman's Cecil Medicine (Vol. 1). Ciencias de la salud de Elsevier
6. Nestler, E. J., Holtzman, D. M., Malenka, R. C., & Hyman, S. E. (2017). Neurofarmacología molecular: fundamentos de neurociencia clínica. McGraw-Hill Interamericana.
7. Andreu, M. C., Miserachs, D. C., Anyo, M. P., Cortés, I. P., Soto, J. S., Brito, S. G., ... & Gali, R. A. Fundamentos de Psicobiología I.
8. Neurohistología. Afifi A.K., & Bergman R.A.(Eds.), (2021). Neuroanatomía Funcional: Texto y Atlas, 3e. McGraw Hill. https://accessmedicina.mhmedical.com/content.aspx?bookid=3064§ionid=255419364
9. Barenque L, & Mora P (2017). Tejido nervioso. Fortoul van der Goes D.I.(Ed.), Histología y biología celular, 3e. McGraw Hill. https://accessmedicina.mhmedical.com/content.aspx?bookid=1995§ionid=150300743
10. Justo Henriques, S. I., Otero, P., Torres Iglesias, Á. J., & Vázquez González, F. L. (2021). Efecto de la intervención de estimulación cognitiva individual de larga duración para personas con trastorno neurocognitivo leve. Revista de Neurología, 73(4), 121-129.
11. Justo-Henriques, S. I., Marques-Castro, A. E., Otero, P., Vázquez, F. L., & Torres, Á. J. (2019). Programa de estimulación cognitiva individual de larga duración para personas con trastorno neurocognitivo leve: estudio piloto. Rev Neurol, 68, 281-9.
12. Lu, C., Dong, L., Zhou, H., Li, Q., Huang, G., & Liao, L. (2018). G-protein-coupled receptor Gpr17 regulates oligodendrocyte differentiation in response to lysolecithin-induced demyelination. Scientific reports, 8(1), 1-12.
13. Raabe, F. J., Slapakova, L., Rossner, M. J., Cantuti-Castelvetri, L., Simons, M., Falkai, P. G., & Schmitt, A. (2019). Oligodendrocytes as a new therapeutic target in schizophrenia: from histopathological findings to neuron-oligodendrocyte interaction. Cells, 8(12), 1496.
14. Tomlinson, L., Leiton, C. V., & Colognato, H. (2016). Behavioral experiences as drivers of oligodendrocyte lineage dynamics and myelin plasticity. Neuropharmacology, 110, 548-562.
15. Thornton, M. A., & Hughes, E. G. (2020). Neuron-oligodendroglia interactions: Activity-dependent regulation of cellular signaling. Neuroscience letters, 727, 134916.
16. Xin, W., & Chan, J. R. (2020). Myelin plasticity: sculpting circuits in learning and memory. Nature Reviews Neuroscience, 21(12), 682-694.
17. Sanches, C., Stengel, C., Godard, J., Mertz, J., Teichmann, M., Migliaccio, R., & Valero-Cabré, A. (2021). Past, present, and future of non-invasive brain stimulation approaches to treat cognitive impairment in neurodegenerative diseases: Time for a comprehensive critical Jarjour,
18. A. A., Boyd, A., Dow, L. E., Holloway, R. K., Goebbels, S., Humbert, P. O., ... & Ffrench-Constant, C. (2015). The polarity protein Scribble regulates myelination and remyelination in the central nervous system. PLoS biology, 13(3), e1002107.Bacmeister, C. M., Barr, H. J., McClain,
19. C. R., Thornton, M. A., Nettles, D., Welle, C. G., & Hughes, E. G. (2020). Motor learning promotes remyelination via new and surviving oligodendrocytes. Nature neuroscience, 23(7), 819-831.
20. Thornton, M. A., & Hughes, E. G. (2020). Neuron-oligodendroglia interactions: Activity-dependent regulation of cellular signaling. Neuroscience letters, 727, 134916.
21. Wellman, S. M., Cambi, F., & Kozai, T. D. (2018). The role of oligodendrocytes and their progenitors on neural interface technology: a novel perspective on tissue regeneration and repair. Biomaterials, 183, 200-217.
22. Marro, B. S., Skinner, D. D., Cheng, Y., Grist, J. J., Dickey, L. L., Eckman, E., ... & Lane, T. E. (2019). Disrupted CXCR2 signaling in oligodendroglia lineage cells enhances myelin repair in a viral model of multiple sclerosis. Journal of virology, 93(18), e00240-19.
23. Kuhn, S., Gritti, L., Crooks, D., & Dombrowski, Y. (2019). Oligodendrocytes in development, myelin generation and beyond. Cells, 8(11), 1424.
24. Swire, M., Kotelevtsev, Y., Webb, D. J., & Lyons, D. A. (2019). Endothelin signalling mediates experience-dependent myelination in the CNS. Elife, 8, e49493.
25. Gomes-Osman, J., Indahlastari, A., Fried, P. J., Cabral, D. L., Rice, J., Nissim, N. R., ... & Woods, A. J. (2018). Non-invasive brain stimulation: probing intracortical circuits and improving cognition in the aging brain. Frontiers in aging neuroscience, 10, 177.
26. Brambilla, M., Dinkelbach, L., Bigler, A., Williams, J., Zokaei, N., Cohen Kadosh, R., & Brem, A. K. (2021). The Effect of Transcranial Random Noise Stimulation on Cognitive Training Outcome in Healthy Aging. Frontiers in neurology, 12, 268.
27. Sanches, C., Stengel, C., Godard, J., Mertz, J., Teichmann, M., Migliaccio, R., & Valero-Cabré, A. (2021). Past, present, and future of non-invasive brain stimulation approaches to treat cognitive impairment in neurodegenerative diseases: Time for a comprehensive critical review. Frontiers in Aging Neuroscience, 378.
28. Indahlastari, A., Hardcastle, C., Albizu, A., Alvarez-Alvarado, S., Boutzoukas, E. M., Evangelista, N. D., ... & Woods, A. J. (2021). A systematic review and meta-analysis of transcranial direct current stimulation to remediate age-related cognitive decline in healthy older adults. Neuropsychiatric Disease and Treatment, 17, 971.
29. Woods, A. J., Cohen, R., Marsiske, M., Alexander, G. E., Czaja, S. J., & Wu, S. (2018). Augmenting cognitive training in older adults (The ACT Study): Design and Methods of a Phase III tDCS and cognitive training trial. Contemporary clinical trials, 65, 19-32.
30. Harrington, E. P., Bergles, D. E., & Calabresi, P. A. (2020). Immune cell modulation of oligodendrocyte lineage cells. Neuroscience letters, 715, 134601.
31. Antal, A., Alekseichuk, I., Bikson, M., Brockmöller, J., Brunoni, A. R., Chen, R., ... & Paulus, W. (2017). Low intensity transcranial electric stimulation: safety, ethical, legal regulatory and application guidelines. Clinical Neurophysiology, 128(9), 1774-1809.
32. Begemann, M. J., Brand, B. A., Ćurčić-Blake, B., Aleman, A., & Sommer, I. E. (2020). Efficacy of non-invasive brain stimulation on cognitive functioning in brain disorders: a meta-analysis. Psychological medicine, 50(15), 2465-2486.
33. Cernera, S., Okun, M. S., & Gunduz, A. (2019). A review of cognitive outcomes across movement disorder patients undergoing deep brain stimulation. Frontiers in neurology, 10, 419.
34. Holczer, A., Németh, V. L., Vékony, T., Vécsei, L., Klivényi, P., & Must, A. (2020). Non-invasive brain stimulation in Alzheimer's disease and mild cognitive impairment—a state-of-the-art review on methodological characteristics and stimulation parameters. Frontiers in Human Neuroscience, 14, 179.
35. Kim, T. D., Hong, G., Kim, J., & Yoon, S. (2019). Cognitive enhancement in neurological and psychiatric disorders using transcranial magnetic stimulation (TMS): a review of modalities, potential mechanisms and future implications. Experimental Neurobiology, 28(1), 1.
36. Brem, A. K., Di Iorio, R., Fried, P. J., Oliveira-Maia, A. J., Marra, C., Profice, P., ... & Pascual-Leone, A. (2020). Corticomotor plasticity predicts clinical efficacy of combined neuromodulation and cognitive training in Alzheimer’s Disease. Frontiers in aging neuroscience, 200.
37. Belgrad, J., Dutta, D. J., Bromley‐Coolidge, S., Kelly, K. A., Michalovicz, L. T., Sullivan, K. A., ... & Fields, R. D. (2019). Oligodendrocyte involvement in gulf war illness. Glia, 67(11), 2107-2124.
38. Janowska, J., & Sypecka, J. (2018). Therapeutic strategies for leukodystrophic disorders resulting from perinatal asphyxia: focus on myelinating oligodendrocytes. Molecular Neurobiology, 55(5), 4388-4402.
39. Ettle, B., Schlachetzki, J., & Winkler, J. (2016). Oligodendroglia and myelin in neurodegenerative diseases: more than just bystanders?. Molecular neurobiology, 53(5), 3046-3062.
40. Philips, T., & Rothstein, J. D. (2017). Oligodendroglia: metabolic supporters of neurons. The Journal of clinical investigation, 127(9), 3271-3280.
41. Ferreira, S., Pitman, K. A., Summers, B. S., Wang, S., Young, K. M., & Cullen, C. L. (2021). Oligodendrogenesis increases in hippocampal grey and white matter prior to locomotor or memory impairment in an adult mouse model of tauopathy. European Journal of Neuroscience, 54(5), 5762-5784.
42. Benamer, N., Vidal, M., Balia, M., & Angulo, M. C. (2020). Myelination of parvalbumin interneurons shapes the function of cortical sensory inhibitory circuits. Nature communications, 11(1), 1-14.
43. Mozafari, S., Starost, L., Manot-Saillet, B., Garcia-Diaz, B., Xu, Y. K. T., Roussel, D., ... & Baron-Van Evercooren, A. (2020). Multiple sclerosis iPS-derived oligodendroglia conserve their properties to functionally interact with axons and glia in vivo. Science advances, 6(49), eabc6983.
44. Gacem, N., & Nait-Oumesmar, B. (2021). Oligodendrocyte development and regenerative therapeutics in multiple sclerosis. Life, 11(4), 327.
45. Mozafari, S., & Baron-Van Evercooren, A. (2021, August). Human stem cell-derived oligodendrocytes: From humanized animal models to cell therapy in myelin diseases. In Seminars in Cell & Developmental Biology (Vol. 116, pp. 53-61). Academic Press.
46. Hughes, E. G., & Stockton, M. E. (2021). Premyelinating Oligodendrocytes: Mechanisms Underlying Cell Survival and Integration. Frontiers in Cell and Developmental Biology, 1985.
47. Klein, B., Mrowetz, H., Kreutzer, C., Rotheneichner, P., Zaunmair, P., Lange, S., ... & Aigner, L. (2020). DCX+ neuronal progenitors contribute to new oligodendrocytes during remyelination in the hippocampus. Scientific reports, 10(1), 1-17.
48. Romanella, S. M., Sprugnoli, G., Ruffini, G., Seyedmadani, K., Rossi, S., & Santarnecchi, E. (2020). Noninvasive brain stimulation & space exploration: opportunities and challenges. Neuroscience & Biobehavioral Reviews, 119, 294-319.
49. Brem, A. K., Di Iorio, R., Fried, P. J., Oliveira-Maia, A. J., Marra, C., Profice, P., ... & Pascual-Leone, A. (2020). Corticomotor plasticity predicts clinical efficacy of combined neuromodulation and cognitive training in Alzheimer’s Disease. Frontiers in aging neuroscience, 200.
50. Kivimäki, M., Walker, K. A., Pentti, J., Nyberg, S. T., Mars, N., Vahtera, J., ... & Lindbohm, J. V. (2021). Cognitive stimulation in the workplace, plasma proteins, and risk of dementia: three analyses of population cohort studies. bmj, 374.
51. Birba, A., Ibáñez, A., Sedeño, L., Ferrari, J., García, A. M., & Zimerman, M. (2017). Non-invasive brain stimulation: a new strategy in mild cognitive impairment?. Frontiers in Aging Neuroscience, 9, 16.
52. Edwards, G., Contò, F., Bucci, L. K., & Battelli, L. (2020). Controlling brain state prior to stimulation of parietal cortex prevents deterioration of sustained attention. Cerebral Cortex Communications, 1(1), tgaa069.
53. Ekhtiari, H., Tavakoli, H., Addolorato, G., Baeken, C., Bonci, A., Campanella, S., ... & Hanlon, C. A. (2019). Transcranial electrical and magnetic stimulation (tES and TMS) for addiction medicine: a consensus paper on the present state of the science and the road ahead. Neuroscience & Biobehavioral Reviews, 104, 118-140.



Comentarios